糖酵解在癌症代谢中起关键作用,糖酵解的增加为细胞的生长和增殖提供了必要的合成代谢支持。虽然糖酵解抑制是癌症治疗的理想靶点,但其是所有细胞都必须有的过程,所以如何实现足够大的抗肿瘤活性而避免其毒性是非常具有挑战的。之前的研究设计了一种创新的治疗策略,称为附加性致死,其利用删除肿瘤抑制基因附近的代谢酶而导致癌症对特定的代谢产生敏感性【1】。例如1p36肿瘤抑制位点的纯合缺失会导致糖酵解酶ENO1在多形性胶质母细胞瘤(GBM)等癌症细胞中的附带删除。烯醇化酶是一种细胞必需的酶,在糖酵解中催化2-磷酸甘油酯(2-PG)转化为磷酸烯醇丙酮酸(PEP)。ENO1纯合缺失的肿瘤对其冗余的旁系同源ENO2的抑制异常敏感【2】,而野生型ENO1组织则不受影响,这样就确保选择性靶向ENO1缺失的肿瘤细胞,保证了充足的治疗窗口。虽然非特异性光谱烯醇化酶抑制剂对ENO1缺失的胶质瘤细胞的选择性比ENO1-WT细胞高出50倍,但ENO1是红细胞中唯一表达的亚型,非特异性烯醇化酶抑制剂可靶向红细胞而产生副作用。所以,如果想要实现这种附加性致死的治疗策略,需要研发特异性靶向ENO2的抑制剂。近日,来自MD安德森癌症中心的Florian L. Muller在Nature Metabolism杂志发表文章An enolase inhibitor for the targeted treatment of ENO1-deleted cancers,研发出一种小分子烯醇化酶抑制剂POMHEX可在低纳摩尔浓度下选择性杀死ENO1缺失的胶质瘤细胞,并在非人类灵长类动物耐受的剂量下根除小鼠颅内ENO1缺失的原位肿瘤。首次证明附加性致死这种治疗策略的可行性,并证明POMHEX在糖酵解抑制方面的功能。

研究人员首先进行结构-活性-关系(structure-activity-relationship,SAR)研究,设计出一种含膦酸盐的烯醇化酶抑制剂HEX,其对ENO2的特异性是ENO1的4倍。HEX的结构类似于2-PG,是一种底物竞争性烯醇化酶抑制剂,生理pH下呈负离子性,降低其细胞和组织的通透性,于是设计了一种细胞渗透性的POMHEX。1周的治疗发现,HEX对ENO1-/-细胞抑制效果的IC50是1.3uM,而对ENO1完整的细胞的IC50是>300uM;POMHEX对ENO1-KO细胞的IC50约为30nM,而对ENO1-WT细胞的IC50是>1.5uM。平均而言,POMHEX的抑制效果是HEX的50倍,在不同的细胞系中略有差异。为了验证POMHEX对靶细胞的杀伤是由于抑制其糖酵解,对相关的靶标标志物进行检测。纳摩尔的POMHEX和微摩尔的HEX都能导致ENO1缺失细胞表现出ATP选择性耗竭和细胞外酸化率的剂量依赖性降低。即POMHEX选择性靶向ENO1缺失细胞,是一种强力的糖酵解抑制剂。为了探究烯醇化酶抑制对上下游代谢物的影响,利用不同浓度的POMHEX处理ENO1缺失、ENO1缺失-回补和ENO1完整的胶质瘤细胞,发现POMHEX对ENO1完整的胶质瘤细胞影响较小,而显著影响ENO1缺失的细胞。高浓度的POMHEX对ENO1缺失-回补和ENO1完整胶质瘤细胞的细胞增殖、细胞死亡、应激等相关蛋白的表达没有影响;ENO1缺失细胞中,低浓度的POMHEX抑制细胞增殖,高浓度诱发细胞凋亡;ENO1缺失细胞中,~180nM POMHEX可诱导应激反应。将这些细胞信号标记物与糖酵解通量(乳酸分泌)、烯醇化酶抑制(甘油酸水平)、能量储备(磷酸化肌酸/肌酸)和能量应激(焦磷酸盐)等过程的代谢指标相关联。发现导致细胞应激标志物升高的POMHEX浓度可以导致能量胁迫的代谢物指标升高;细胞增殖受到抑制的POMHEX浓度,可略微降低糖酵解通量,即胶质瘤细胞将减少能量产生(糖酵解通量)和减少能量消耗(增殖)联系在一起,以应对外界环境。进一步研究发现,ENO1缺失细胞中,柠檬酸(TCA)循环中代谢物显著减少,例如富马酸盐下降了90%以上,表明糖酵解过程中的葡糖糖代谢是TCA循环回补底物的主要来源,且POMHEX的大多数毒性来源于糖酵解ATP产生的阻断,而产生的生物能衰竭。同时,POMHEX处理导致的最显著的代谢物积累发生在糖酵解的支链反应——己糖胺生物合成途径(HBP),其中N-乙酰氨基葡萄糖-磷酸的含量提高了15倍,水解产物N-乙酰氨基葡萄糖的含量提高了60倍以上;非氧化性戊糖磷酸分流的中断,S7P和红细胞-4-磷酸酯的浓度增加了12倍。在shRNA敲低ENO2的ENO1缺失细胞中可以观察到类似的现象。研究人员进一步对POMHEX和HEX的生物耐受性和抗肿瘤活性进行检测。HEX静脉注射剂量达到300mg/kg时,或皮下注射300mg/kg(一天2次)时,小鼠没有出现贫血或体重降低等明显的毒性作用;而POMHEX则静脉注射剂量达到10mg/kg,最高单次耐受剂量达到30mg/kg。在两种ENO1缺失的脑胶质瘤小鼠模型中,HEX和POMHEX均显著降低肿瘤生长,提高3-PG和甘油酯水平,长期治疗可完全消除肿瘤且没有复发。药代动力学显示,小鼠血浆中POMHEX被快速水解为HemiPOMHEX,半衰期为30s,而人类血浆中半衰期为9min。小鼠体内实验显示,完整的POMHEX低于小鼠血浆中的定量水平,而HemiPOMHEX和HEX则很容易观察到。POMHEX快速水解是血浆羧酸酯酶所介导的,所以导致心脏中HEX的过度积累和最大程度的烯醇化酶抑制活性,如3-PG和甘油酸盐的升高;而任何器官或血浆中均为出现乳酸的显著降低,甘油酸的积累仅在大脑中观察到。最后,研究人员进一步在非人类灵长类中检测生物耐受性,发现静脉注射剂量可达到20mg/kg,而皮下注射剂量可达到200mg,过高的剂量可能导致嗜睡和严重的低血糖。即灵长类动物对有效剂量的POMHEX或HEX具有良好的耐受性。灵长类动物的羧酸酯酶活性较低,这使得药物暴露时间更长,而且由于前体药物的激活较慢,可能会降低机体对POMHEX的敏感性。在灵长类动物中的高度安全性,或提示我们POMHEX和HEX在灵长类动物和临床上或可取得较好的抗肿瘤治疗效果。
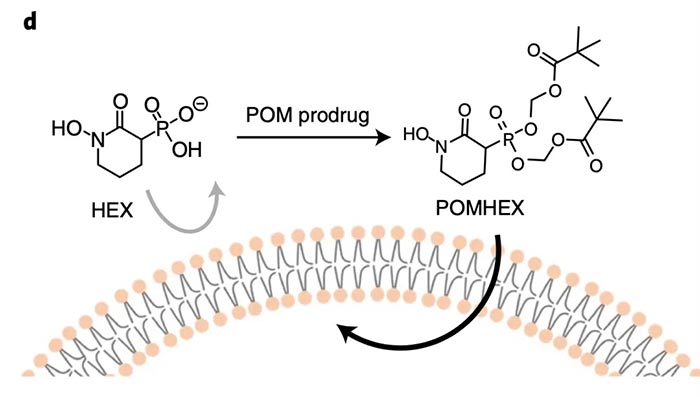
总的来说,研究开发出小分子烯醇化酶抑制剂——POMHEX,可实现在纳摩尔浓度下进行抑制,同时能够被动物体所耐受,根除小鼠体内ENO1-KO肿瘤。首次验证了附加性致死这种治疗策略的可行性,并提示我们附加性致死这种治疗策略或可作为治疗连带缺失(passenger deletion)类型肿瘤的一种方法。https://doi.org/10.1038/s42255-020-00313-31. Muller, F. L. et al. Passenger deletions generate therapeutic vulnerabilities in cancer. Nature 488, 337–343 (2012).2. Leonard, P. G. et al. SF2312 is a natural phosphonate inhibitor of enolase. Nat. Chem. Biol. 12, 1053–1058 (2016).



